抗生素耐药性(AMR)在人类、环境和动植物间的传播大大加剧了全球“One Health”负担。土壤是“One Health”的关键环节之一,所携带的抗生素耐药性可通过食物链等方式转移至人类而带来健康威胁。土壤中栖息着地球上最为丰富多样的微生物,其中的活性耐药菌在驱动土壤耐药性传播中起着关键作用。然而,由于高达99%的土壤微生物不可培养,针对土壤原位活性耐药菌的探索仍很少,土壤中抗生素耐药性风险的研究仍然面临巨大挑战,阻碍了AMR环境行为及阻控策略的发展。
虽然分子生物学技术提升了我们对土壤微生物组和抗性组的认识,但基因信息仅反映耐药潜力而非耐药表型,且不能区分胞外、死亡或休眠菌的DNA,因此难以剖析具体发挥作用的耐药微生物,影响了AMR健康风险的精确评估。基于培养的方法仅能关注少数可培养的指示菌,忽视了土壤中大量未培养菌的贡献。因此,亟需开发合适的技术手段,从表型和基因型两个层面全面解析土壤中重要的活性耐药菌。
2022年9月,中国科学院城市环境研究所朱永官院士团队在PNAS期刊发表了题为Active antibiotic resistome in soils unraveled by single-cell isotope probing and targeted metagenomics的文章。通过发展单细胞拉曼-稳定同位素标记和靶向宏基因组联用技术,示踪了土壤原位活性抗生素耐药菌,量化了其表型耐药水平,并结合单细胞靶向分选与测序揭示了土壤高活性耐药菌的抗性组和移动组。朱永官院士团队长期致力于环境耐药性的研究,并在“One Health”的大背景下提出监测和防控抗生素耐药风险的方法理论框架。团队骨干崔丽研究员长期致力于环境微生物单细胞前沿技术的开发研究,近年来针对环境耐药性,在发展单细胞拉曼表型手段结合靶向分选测序,提升环境(土壤、水体、塑料际)耐药菌的监测水平和传播研究上取得系列成果,受到国内外同行关注。
该研究首先利用单细胞拉曼-重水同位素标记技术,针对土壤的复杂性以及对抗生素有效性的影响,通过优化抗生素剂量、孵育时间、采谱深度,建立了准确示踪土壤活性耐药菌的单细胞方法及判别标准,并利用土壤原位环境的多种已知抗性菌和敏感菌,对方法在不同土壤和不同机制抗生素的普适性和准确性,进行了交互验证,成功将方法从简单的临床耐药菌的研究拓展至包含大量未培养菌的复杂土壤环境。
利用该方法,在单细胞水平和表型层面,克服培养限制,直接示踪和定量了土壤原位活性耐药菌的丰度和活性水平,揭示出人类活动(如农业耕种和污染排放)显著增加了土壤的表型耐药水平。由于高代谢活性耐药菌对AMR环境传播的重要作用,进一步提出将表型耐药水平作为环境AMR风险评价一种新指标,弥补了长期以来AMR风险评价仅有基因信息,而无耐药表型信息的空白。
针对拉曼技术识别的具有潜在健康风险的高度活跃土壤耐药菌,利用单细胞分选与靶向宏基因组测序技术,鉴定出多数高表型耐药菌属于之前难以研究的未培养菌,以及一株新型的抗生素抗性病原菌,证明了土壤未培养菌是AMR的重要宿主。团队在单细胞水平破译了活性耐药菌携带的抗性基因、毒力因子、可移动遗传元件(包括质粒、插入序列和前噬菌体)。该工作将多种抗生素耐药表型和多种基因型关联,为解析环境中大量未培养耐药菌提供了崭新的方法。
综上,该工作所发展的单细胞拉曼结合靶向宏基因组的方法,为复杂环境耐药研究提供了新手段,深化了我们对土壤活性抗生素耐药性的认知。该方法可广泛用于其它生态系统,对在“One Health”框架下推进环境耐药性的风险评估与制定防控策略,具有重要价值。
李弘哲博士为第一作者,崔丽研究员和朱永官研究员为通讯作者。该研究得到国家自然科学优秀青年科学基金(21922608),创新研究群体项目(42021005), 面上项目(22176186),以及中科院从0到1原始创新项目(ZDBS-LY-DQC027)的资助。
论文链接
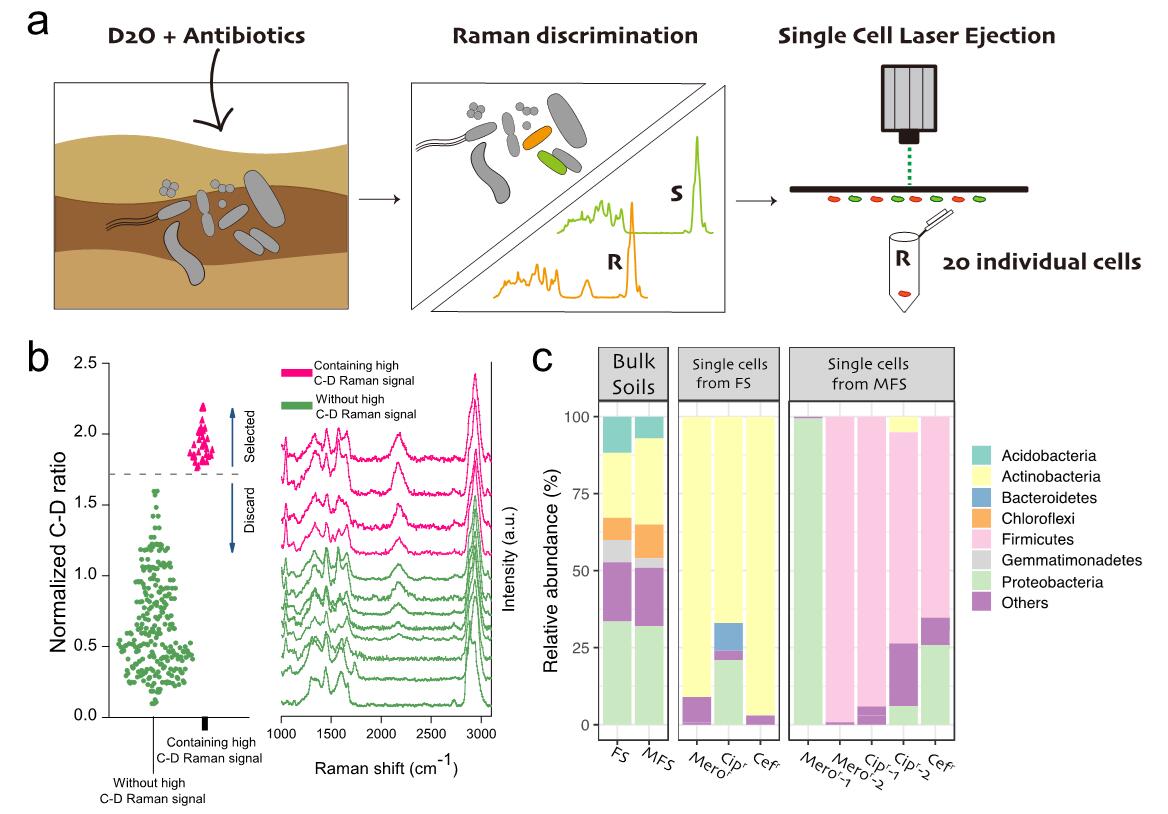
单细胞拉曼技术评估土壤表型耐药性并靶向分选和测序高活性耐药菌